
Artigos relacionados:
Átomos são a parte fundamental de todos os elementos químicos, que quando combinados, graças as interações fundamentais da natureza, formam tudo o que conhecemos, desde o oxigênio que respiramos até as células em nosso sangue.
É através desta composição fundamental, que a natureza conecta tudo o que há no universo, sob o mesmo princípio.
O que diferencia uma rocha de uma pétala de flor, é apenas a forma como estes átomos estão organizados, e é o que torna este princípio tão inteligente, elegante e belo, capaz de compor mundos inteiros, com toda a diversidade que se pode imaginar!

Átomos possuem um núcleo, composto por prótons e nêutrons, que são orbitados por elétrons.
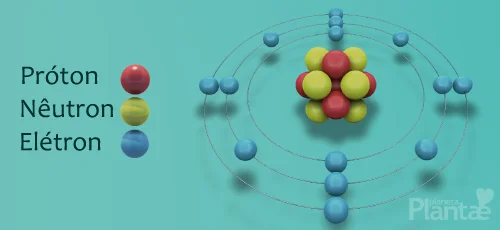
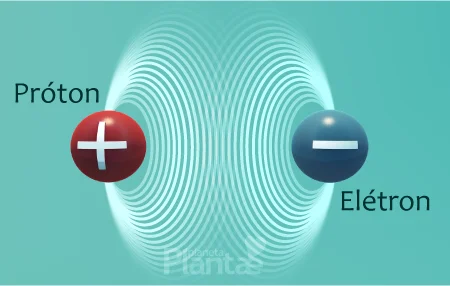
No núcleo, os prótons possuem carga elétrica positiva que os permite interagir com os elétrons que possuem carga negativa, mantendo-os, assim, em sua órbita. Esta é a interação eletromagnética, que é uma das interações fundamentais da natureza.
Os nêutrons não possuem carga elétrica, e existem apenas para manter os prótons coesos no núcleo, e impedir que eles se afastem uns dos outros.
Como os prótons são positivos, eles se repeliriam se não houvesse mais nada com que interagirem, e o átomo deixaria de existir.

É então que uma outra interação fundamental da natureza entra em ação: a interação nuclear forte.
Apesar desta interação atuar em escalas muito pequenas (pouco maiores que o diâmetro do próprio próton ou nêutron), é a mais poderosa na natureza. Por isso quando estas partículas estão próximas o suficiente, esta interação é capaz de vencer o eletromagnetismo que tenta repeli-las, conseguindo as manter coesas em um núcleo.
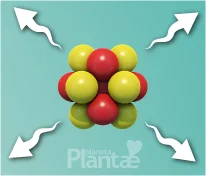
Este delicado equilíbrio forma os blocos de construção de tudo o que conhecemos, e para que se mantenha, é importante que o número de prótons e nêutrons no núcleo, seja tal que as interações entre eles sejam proporcionais, de modo que uma não se apresente em maior intensidade que outra.
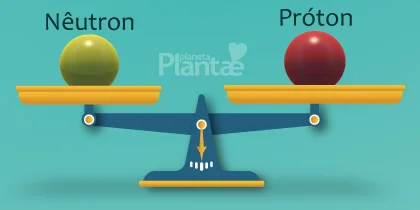
Acontece que cada elemento químico possui sua identidade que o define como único na natureza, seja do hidrogênio, que é o mais simples de todos, até o urânio que é o elemento natural mais complexo.
Esta identidade é definida pelo número de prótons no núcleo do átomo:
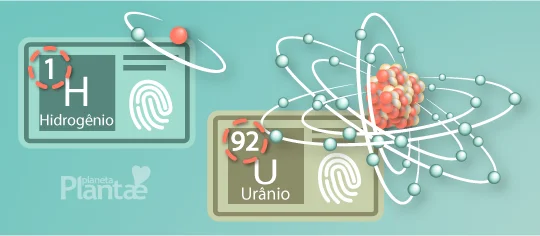
Se o hidrogênio ganhasse mais um próton, ele se tornaria hélio, que é o segundo elemento na tabela periódica, e que possui dois prótons. Esta é, portanto, a forma como estes elementos são organizados.

Contudo, na natureza, estes elementos podem, eventualmente, possuir quantidades desiquilibradas de nêutrons em seus núcleos.
Como a quantidade de prótons se mantém, o elemento em questão não perde sua identidade, mas como a quantidade de nêutrons se desequilibra, o seu núcleo torna-se instável, já que as interações ficam desiguais.

E estes são os isótopos: variações dos elementos, que apesar de não os alterar quimicamente (um isótopo de carbono, continua sendo carbono, pois o número de prótons e a configuração eletrônica são iguais), os altera fisicamente, dando-lhes comportamentos distintos, como a instabilidade nuclear.
Isto significa que o isótopo, com suas interações nucleares desiquilibradas, se torna “frágil”, e com o tempo, seu núcleo fissura (rompimento).
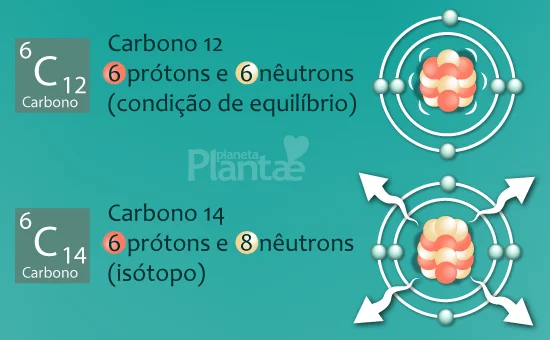
Quando um átomo sofre fissão, ele decai e se torna outro elemento químico! É neste evento que outra interação fundamental da natureza atua: a força nuclear fraca.
Esta interação só não é mais fraca que a gravidade (que é quase desprezível em escala atômica), mas é capaz de alterar os estados internos dos prótons e nêutrons, forçando-os a se desprenderem do núcleo: a fissão nuclear.
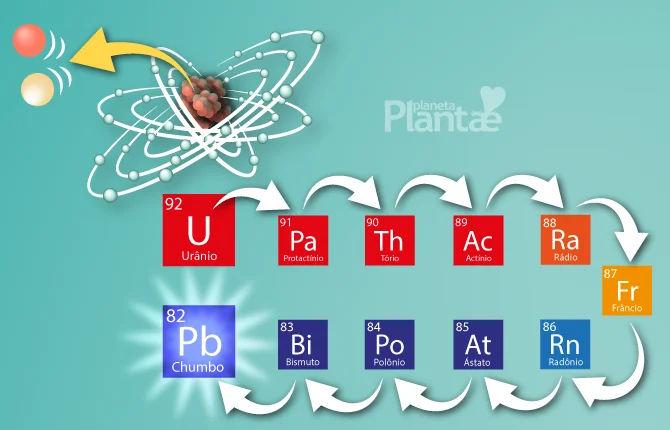
E já que o número de prótons determina a identidade do elemento, quando ele os perde, torna-se outro elemento: o elemento abaixo na tabela periódica, ou seja, aquele que possui menos prótons, por isso dizemos decaimento.
Por exemplo, isótopos de urânio decaem até tornarem-se o último elemento natural estável da tabela periódica: o chumbo.

O interessante é que ao sofrer ruptura do núcleo, o átomo não apenas libera suas partículas, mas também energia!
Esta energia é liberada na forma de radiação (decaimento radioativo), que pode ser corpuscular, como os raios alfa e beta, ou ainda eletromagnética, como raios gama emitidos pelo Sol em suas erupções, que seriam prejudiciais à Terra, se não fosse a sua magnetosfera.
Mesmo sob sua proteção, parte desta radiação consegue penetrar e atingir os gases atmosféricos, produzindo ondas visíveis do espectro e que são orientadas pelo fluxo do campo magnético da Terra, formando as auroras boreais no polo norte, e as auroras austrais no polo sul… mas este é assunto para outro artigo!

Para complementar o conhecimento!
Alguns elementos químicos mais simples, possuem isótopos não perigosos, pois não liberam radiação nociva.
Entretanto, elementos mais pesados podem possuir isótopos perigosos, que são os chamados radioisótopos, pois liberam energia na forma de radiação prejudicial, pois são capazes de penetrar corpos sólidos e causar danos nos átomos que os compõem, como o câncer quando penetram as nossas células, por exemplo. Isso acontece pois “danificam” o código genético ao interagirem com as moléculas constituintes.
Existem ainda elementos químicos que são sempre instáveis, pois o seu número de prótons e nêutrons é tão grande que o equilíbrio no núcleo se torna impossível, quer sejam isótopos ou não, como é o caso do urânio.
Com 92 prótons, é muito difícil que suas partículas se mantenham estáveis, o que faz com que este elemento, mesmo em sua condição normal (aquela que se apresenta em maior abundância na natureza), seja totalmente instável, tornando-o um elemento naturalmente radioativo.
O urânio decai naturalmente até se tornar o elemento chumbo, que é o último elemento natural estável na natureza, com 82 prótons. Este processo leva 4,5 bilhões de anos (na condição mais abundante do urânio na natureza: o urânio 238 = 92 prótons + 146 nêutrons).
Mas existem outros isótopos que decaem muito mais rapidamente, como o césio 137, responsável pelo acidente nuclear em Goiânia, em 1987, que leva cerca de 30 anos para decair.
Fontes de pesquisa:
Artigo “Isotope” da Wikipédia, em https://en.wikipedia.org/wiki/Isotope
Artigo “Atomic number” da Wikipédia, em https://en.wikipedia.org/wiki/Atomic_number
Artigo “Radioactive decay” da Wikipédia, em https://en.wikipedia.org/wiki/Radioactive_decay
Artigo “Stable nuclide” da Wikipédia, em https://en.wikipedia.org/wiki/Stable_nuclide
Artigo “Proton decay” da Wikipédia, em https://en.wikipedia.org/wiki/Proton_decay
Artigo “Proton emission” da Wikipédia, em https://en.wikipedia.org/wiki/Proton_emission
Artigo “Alpha decay” da Wikipédia, em https://en.wikipedia.org/wiki/Alpha_decay
Publicação “Decaimentos Radioativos”, disponível em https://www.fq.pt/images/alunos/12/12ano-F-3-2-2-decaimentos-radioativos.pdf
Artigo “Radioatividade” da Wikipédia, em https://pt.wikipedia.org/wiki/Radioatividade
Artigo “Isotopes” da Encyclopaedia Britannica , em https://www.britannica.com/science/isotope
